
英语原文共 6 页,剩余内容已隐藏,支付完成后下载完整资料
由铜/氧化锌催化剂的晶格氧参与的甲醇氧化的原位漫反射红外光谱研究
Shawn D. Lin a, Hongkui Cheng a,Ting C. Hsiao b
a化学工程系,国立台湾科技大学,台北,台湾,中华民国
b化学工程与材料科学,元智大学,中坜,台湾,中华民国
摘要
先前的研究表明,铜催化剂的晶格氧参与了甲醇的转化。在这项研究中,铜/氧化锌催化剂通过预处理后变得完全氧化,部分还原或完全还原。原位漫反射红外光谱 (In situ DRIFTS) 是用于分析在393 K和逐步程序升温脱附 (sTPD) 条件下甲醇 (MeOH) 的吸附。除了甲氧基和甲酸盐在甲醇吸附后出现外,通过铜/氧化锌催化剂还会得到甲醛,值得注意的是当铜被完全还原时不会出现二氧化碳 (CO2) 。但当铜处在氧化或部分还原的状态下时,就会产生CO2并形成更多的甲酸。晶格氧参与了甲醇的转化,并且在部分还原状态下的铜/氧化锌中反应率比氧化状态下的铜/氧化锌要高一些。这表明还原铜可以促进甲醇吸附物和晶格氧催化反应。
- 绪论
铜催化剂,特别是铜/氧化锌,广泛应用于许多传统领域,如水气交换反应 (WGS) [1, 2],甲醇合成 (MS) [3-7],低碳醇合成 (HAS) [8-10],甲醇分解(MD)[11-15],甲醇部分氧化(POM)[16],和甲醇水蒸气重整反应 (SRM) [19]。为了生产无CO氢燃料电池,研究人员最近集中于POM(甲醇 氧气),SRM(甲醇 水),或者甲醇氧化重整(有机磁共振,甲醇 氧气 水)的反应研究[17-23]。这些反应是非常复杂的,有时是相互关联的。最好的例子出现在Peppley等的文章中(22, 23)。他指出,甲醇分解,甲醇水蒸气重整反应,水气交换反应都必须包括在甲醇水蒸气重整反应的动力学分析中。在反应过程中铜/氧化锌的工作状态尚不清楚,可能会随着不同的反应条件发生改变。对于甲醇分解和甲醇水蒸气重整反应来说, Cu0被认为是最活跃的最活跃的铜/氧化锌催化剂 [12, 19, 24]。 Reitz等 [25] 提出在低氧转换条件下(470 -533 K)进行的有机磁共振中Cu2 是铜/氧化锌的优势群体。然而,由Cu2 还原得到的Cu0主导着高氧转换条件和甲醇水蒸气重整反应的转换途径。 Alejo等[26]提出Cu0在甲醇部分氧化中参与形成了CO2和H2,Cu1 支持形成CO和H2O,并在有机磁共振中Cu2 相对不活跃。这些例子说明了关于铜催化剂在甲醇转化中的状态的争议,并表明,铜在不同条件下有着不同状态。将甲醇分解反应作为参考,我们之前报道,一起通入的物种如H2O和O2不仅可以改变甲醇转化活性和选择性,还能改变铜的状态[27]。我们还研究了不同铜/氧化锌催化剂的还原反应(预处理效应)[28]。部分还原催化剂的晶格氧可以参与反应,导致二氧化碳的形成。为了获得更深刻的预处理效果,这项研究调查了表面物种或媒介在甲醇吸附在不同预处理铜/氧化锌催化剂后的原位漫反射率红外光谱分析(DRIFTS)。先前的研究[29-31]表明,吸收带位置在甲醇吸附铜催化剂还原或在氧化环境中可能会改变。在还原催化剂被再度氧化后[29],甲氧基吸附物的C-H拉伸带中铜/二氧化硅从2923和2816 cmminus;1变成了2935和2823 cmminus;1。Mudalige和Trenary[31]报道当铜 (100) 表面被氧预吸附时,O、CO振动模从1340红移到了1317 cmminus;1。这些结果表明,表面物种的振动模式会随着铜的状态变化而变化。然而,没有研究人员试图说明当温度增加时晶格氧对甲醇吸附物的影响。本研究从不同还原状态的铜/氧化锌催化剂的甲醇吸附物方面报告了原位漫反射率红外光谱分析的结果,并讨论如何晶格氧怎样参与了甲醇的转换。
2 实验
2.1 样品制备
实验研究中涉及商业铜/氧化锌催化剂 (Nissan Girdler G66B; CuO: 30,ZnO: 60,Al2O3: 10 wt%) ,实验中使用的催化剂被研磨至80-120目,参考样本包括粉末金属铜 (Cerac, 99.999%, sim;100 目) ,氧化铜(Cerac, 99%, sim;200目) ,氧化亚铜 (Merck, 99%) 和氧化锌 (Fluka, 99%)。
2.2 原位漫反射红外光谱研究
红外光谱通过Nicolet Magna-IR 550 MCT探测器和漫反射傅立叶变换红外光谱 (DRIFT) 附件 (Thermo Spectra-Tech) 来进行收集。光谱采集的分辨率为4 cmminus;1,并要累计进行64次扫描。参考光谱在流动氮气条件下样本进行预处理并被冷却至实验温度时得出。在研究中使用的氢气和氦气是从San-Fu气体有限公司获得的。高纯度 (gt; 99.99%) 的氢气和氦气在通过干燥器和脱氧柱后使用。甲醇(Merck gt; 99.9%,与脱水分子筛浸泡)通过氦流喷泉进入系统,其温度是由一个温控器控制调节。催化剂粉末装入试样夹的原位单元中,随后在573 K煅烧1 h,然后在不同温度的H2下还原30分钟。在理想的吸附温度下输送甲醇后,甲醇气相和可逆吸附物种是由氦净化到光谱稳定。逐步程序升温脱附 (sTPD) 过程在氦气流向473 K的环境下稳步进行,光谱在每个预定的温度下被收集。
2.3程序温度还原 (TPR)
程序温度还原是用TCD探测器和掺入10%氢气的氮气以5 K/min的加热速率完成的。铜/氧化锌样品的预处理过程是在573 K的温度下煅烧1小时,然后在可控温度下用氢还原30分钟(或省略该步),冷却至室温,然后用TPR进行分析。不同预处理的催化剂的还原程度根据TPR结果中氢的消耗数量计算得出。甲醇吸附和在不同预处理下催化剂还原程度的逐步程序升温脱附也要被审查。先于TPR分析的预处理,甲醇吸附和逐步程序升温脱附过程同原位漫反射红外光谱分析中使用的一样。
3.结果
3.1在Cu、Cu2O、CuO和ZnO中的甲醇吸附
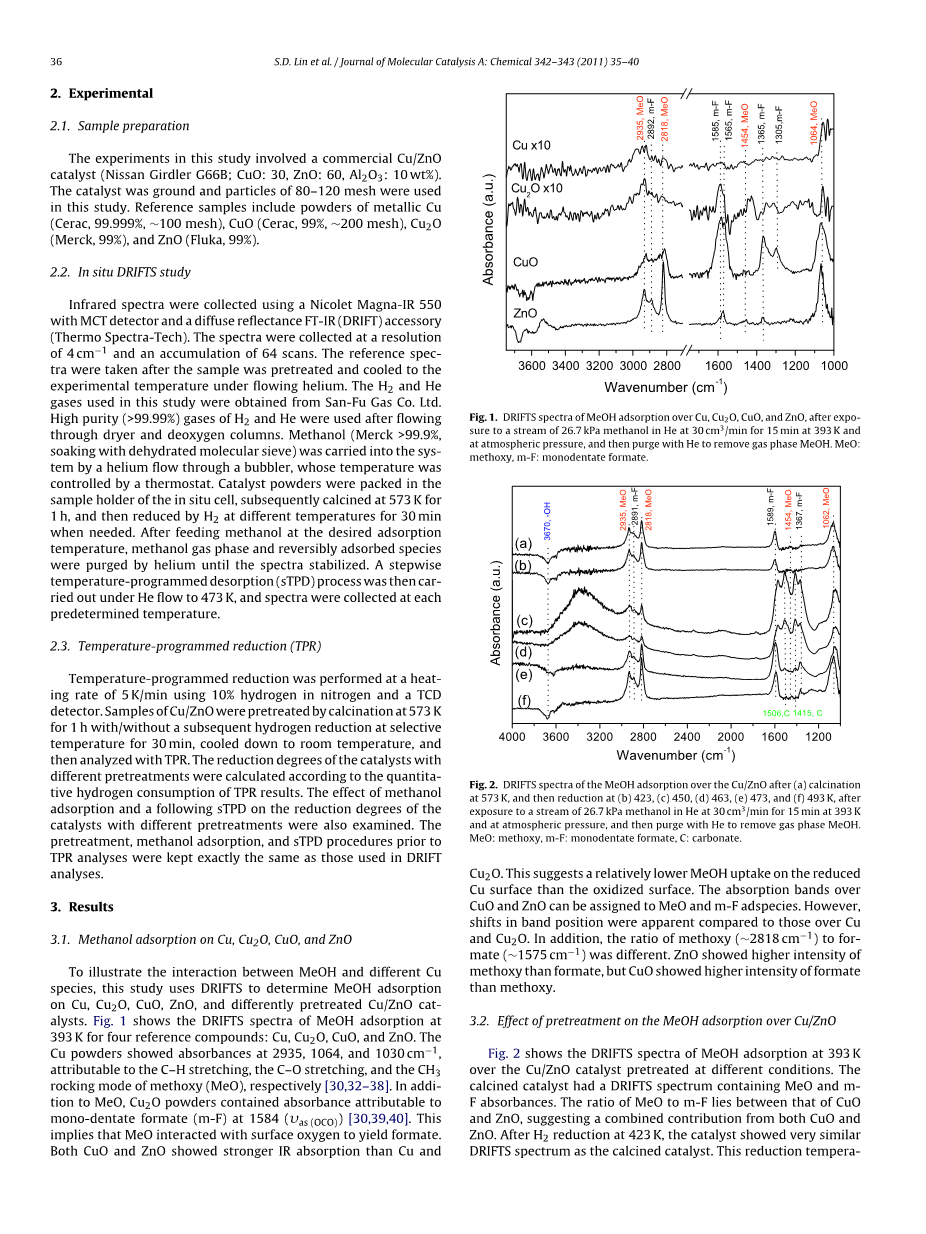
- 为了说明甲醇和不同的铜物种之间的相互作用,本实验使用原位漫反射红外光谱来确定甲醇吸附在Cu、Cu2O、CuO和ZnO和不同预处理的铜/氧化锌催化剂上的情况。图1显示了甲醇吸附在393 K下的原位漫反射红外光谱,四个参考化合物分别是Cu、Cu2O、CuO和ZnO。铜粉显示吸光度在2935、1064和1030 cmminus;1时,可分别归因于碳氢键拉伸,碳氧键拉伸和甲氧基 (MeO) 的甲基摆动模式[30, 32-38]。除此以外MeO、Cu2O粉末含有吸光度可归因于单齿甲酸 (m-f) 在1584 (vas(OCO)) [30, 39, 40]。这意味着甲氧基与甲酸盐的表面氧相互作用。氧化铜和氧化锌都显示出了比铜和氧化亚铜更强的红外吸收比,这表明还原铜表面的甲醇吸收率比氧化表面要低。氧化铜和氧化锌的吸收谱带可以分配给甲醇和单配位基甲酸的表面吸附物。然而,其带位置的变化相对于铜和氧化亚铜比较来说较为明显。此外,甲基氧的比例 (~2812 cm-1) 和甲酸 (1575 cm-1) 是不同的,氧化锌显示了比甲酸更高的甲基氧强度,但氧化铜相对于甲氧基显示出了更高的甲酸强度。
图1:甲醇吸附过程中Cu、Cu2O、CuO和ZnO的原位漫反射红外光谱,在393 K和大气压强下,向氦气中以30 cm3/min的速率注入27.6 Kpa的甲醇气体15分钟,然后用氦气净化去除甲醇气体,MeO:甲氧基和m-f:单齿甲酸。
3.2对吸附在铜/氧化锌上的甲醇的预处理
图2显示了在393 K的不同条件下对吸附在铜/氧化锌上的甲醇进行预处理的原位漫反射红外光谱。煅烧催化剂有着包含了MeO和m-f吸光度的原位漫反射红外光谱。在氧化铜和氧化锌之间的MeO、m-f比率,说明了氧化锌和氧化铜都对其作出了贡献。在423 K H2还原后,催化剂表现出和焙烧催化剂非常相似的原位漫反射红外光谱。还原温度太低而不能使催化剂的氧化态发生任何改变,这一现象也被之前的TPR发现所证实[28]。393 K时甲醇吸附的DRIFTS光谱变更其还原温度上升至450和463 K,与水相关的吸收峰在3000-3500和1300-1600 cmminus;1显著增加。这表明在部分还原的铜/氧化锌催化剂的甲醇吸附中有水的形成。 Ellis和Wang报道了在甲醇吸附中的预吸附氧。Cu (100) 通过两步形成了H2O。在部分还原的铜/氧化锌催化剂的表面吸附物包括MeO、甲酸和碳酸盐。吸光度在1415和1506 cmminus;1间表明碳酸盐的存在。 Weigel等[42]报道说铜/氧化锆的表面碳酸盐出现1700至1200 cmminus;1之间。在图二中也可以看到相似的线型。在1506 cmminus;1处的特性可归属于双齿碳酸盐的OCO不对称伸缩模式。其as和s分别在1512和1325 cmminus;1。在1415 cmminus;1处的特性可归属于多配位基的碳酸盐或不同位碳酸盐。吸光度与还原温度增加到473和493 K时水和碳酸盐的消失有关。而MeO和m-f吸光度也变得更大了。这表明,有更多还原铜的铜/氧化锌催化剂含有有更多MeO和甲酸表面吸附物(图2 (e)和(f))。相对m-f来说MeO相对较高的强度表明氧化锌相对于铜来说对还原铜/氧化锌观察到的光谱做出了更多的贡献。
图2:甲醇吸附过程中铜/氧化锌在535 K煅烧后的原位漫反射红外光谱。随后在 (b) 423, (c) 450, (d) 463, (e) 473和 (f) 493 K还原,在393 K和大气压强下,向氦气中以30 cm3/min的速率注入27.6 Kpa的甲醇气体15分钟,后用氦气净化去除甲醇气体,MeO: 甲氧基, m-f: 单齿甲酸和C: 碳酸根。
3.3甲醇通过铜/氧化锌进行的逐步程序升温脱附
分析甲醇在氧化锌上的吸附是了解甲醇与铜/氧化锌催化剂交互的一个先决条件。图3显示了在393 K甲醇吸附的红外光谱,氧化锌在程序升温脱附法下逐步升温至433和473 K时他们的不同的光谱。在393 K的吸附物种包括甲氧基和m-f,图3中羟基带的负峰值位置(3670 cmminus;1和3618 cmminus;1)表明,羟基团和吸附物相互影响,在甲醇吸附前背景光谱的样品和温度也是相同的。DFT计算表明,甲醇与氧化锌中的羟基互动生成甲氧基和水。相似的情况出现在433和473 K的逐步程序升温脱附中,但一些带的位置发生了变化。在433 K和在473 K(图3(e))中的光谱差异表现为MeO的消失和二齿甲酸(b-f)的形成,在2964、2867、和2739 cmminus;1处的特性说明了b-f的存在,在3050、1441、1263 cmminus;1处吸收峰的出现可能是因为甲酸甲酯 (MF) [30]。温度升高导致ZnO表面的MeO和MeOH吸附物转换成了甲酸盐。
图3:393 K时甲醇吸附在ZnO上的DRIFTS频谱 (a),ZnO通过逐步程序升温脱附至433 K (b)和473 K (c)。不同的频谱包括 (d) 433-393 K和 (e) 473-433 K。MeO:甲氧基和m-f:单齿甲酸。
图4显示了393 K时甲醇吸附在煅烧铜/氧化锌上的原位漫反射红外光谱和差异光谱,然后进行逐步程序升温脱附。在393 K时,表面甲氧基和m-f在甲醇吸附后被发现。当温度逐步增加到433 K和473 K时,甲氧基带的强度降低。与此同时,二氧化碳 (2349 cmminus;1) 和m-f的 (OCO) (1597 cmminus;1) 带强度增加,就像图4的 (d) 和 (e) 中所示光谱的差别。在473 K,带的出现归因于b-f (2870和2740 cmminus;1) 变得可见(图4 (c)),但其强度没有在不同光谱中因温度增加而增加。这表明在393 K甲醇吸附期间b-f形成在一个相对较低的甲醇浓度,并且在逐步程序升温脱附期间
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[151344],资料为PDF文档或Word文档,PDF文档可免费转换为Word


