英语原文共 10 页,剩余内容已隐藏,支付完成后下载完整资料
胰岛素受体的结构动力学和跨膜信号转导
Suren A. Tatulian*
Department of Physics, University of Central Florida, 4111 Libra Drive, Orlando, Florida 32816, United States
摘要:胰岛素受体 (IR) 是一种在细胞代谢中发挥中心作用的(alpha;beta;)2 型跨膜酪氨酸激酶。每个alpha;beta;异源二聚体由 alpha;-亚基和跨膜的beta;-亚基组成,包括细胞质酪氨酸激酶 (TK) 域和磷酸化位点组成。alpha;-和 beta;-亚基通过单个二硫键桥接相连,(alpha;beta;)2 再由二硫键在alpha;链之间形成四聚体。胰岛素结合可以诱导IR达到细胞内的beta;亚基的蛋白磷酸化和激活级联的构象变化。在这个信号传导的过程,包括IR功能障碍引起的突变导致Ⅱ型糖尿病。合理的药物设计旨在治疗糖尿病在跨膜信号转导过程中依赖于IR结构的细节和动态结构转换的改变。最近的 x 射线晶体学研究已应用与IR的研究,由此产生的结构变化和到 TK 域,其传输提供重要线索的胰岛素结合模式但尚未实现的结构基础胰岛素信号转导的一个完整的理解。这篇文章就IR结构-功能之间的关系与其它IR家族受体进行比较评估,并讨论了在阐明胰岛素信号转导的分子机制方面的潜在进步。
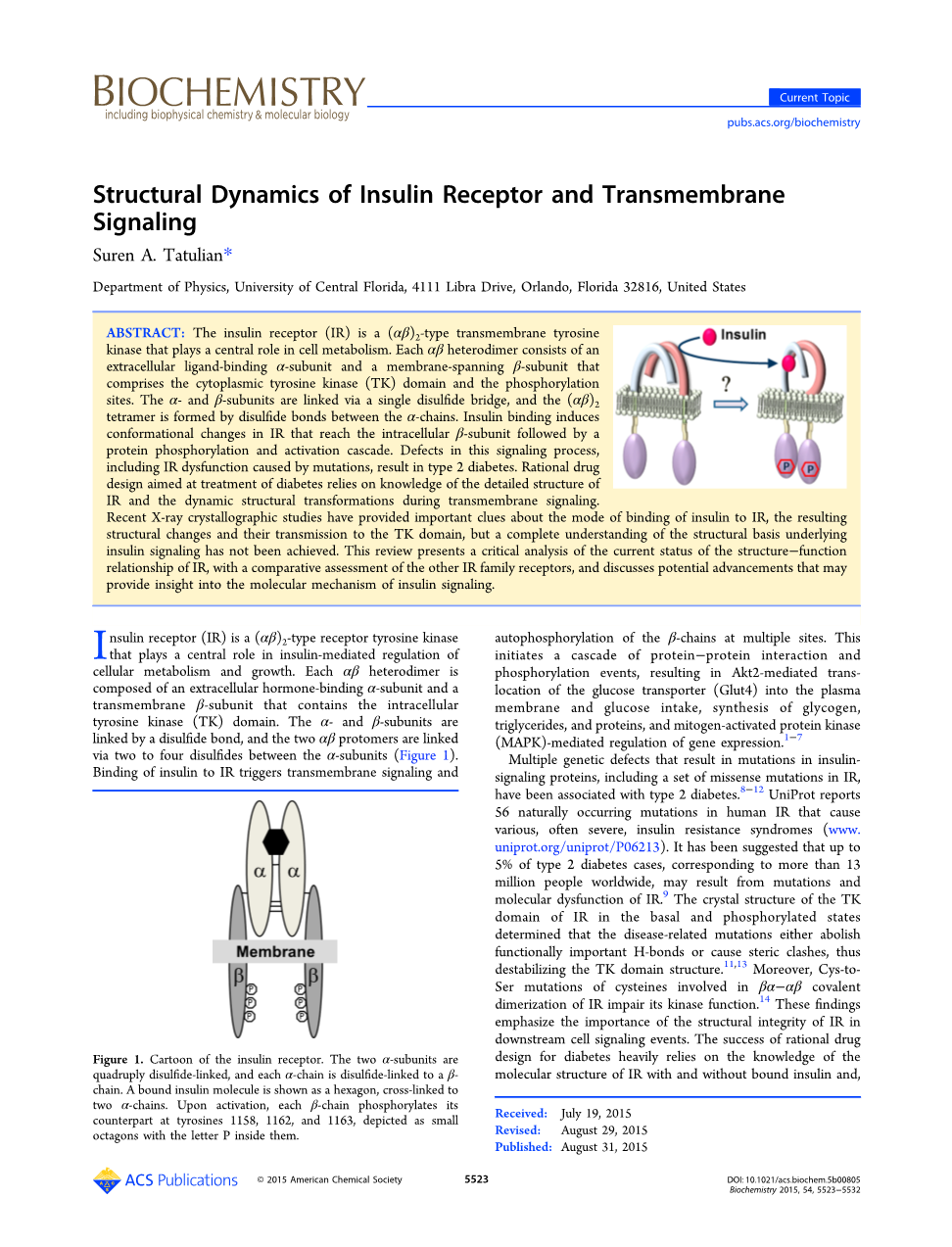
胰岛素受体 (IR) 是一种在胰岛素介导的细胞新陈代谢和生长调节中发挥中心作用d (alpha;beta;)2型受体酪氨酸激酶。每个alpha;beta;异由胞外激素结合alpha;-亚基和包含胞内酪氨酸激酶 (TK) 域跨膜 beta; 亚基组成。alpha;-和beta;-亚基由二硫键链接,再由两个alpha;beta; 原聚体通过两到四个二硫键之间 alpha; 亚基相连,(图1)。结合的胰岛素对IR触发跨膜信号转导和自身磷酸化的 beta;-链在多个位点。这会引发一系列导致葡萄糖转运子 (Glut4) 介导 Akt2 移位的蛋白-蛋白相互作用和磷酸化形成的质膜和葡萄糖摄取,糖原、 甘油三酯和蛋白质合成是由丝裂原活化蛋白激酶 (MAPK)-介导的基因表达的调控。
在胰岛素信号转导蛋白,包括IR,一整套的错义突变基因突变导致的多个遗传缺陷都与Ⅱ型糖尿病相关联。UniProt 56号报告在人类IR的天然突变中大多数能引起胰岛素抵抗综合征 (www.uniprot.org/uniprot/P06213 ),是一种很严重的疾病。有人提出上升到5%的突变类型与Ⅱ糖尿病有关的情况下,对应于全世界,有超过 1300 万人会由突变与分子导致的 IR功能障碍。IR在基部和磷酸化状态的 TK 域的晶体结构确定疾病相关的基因突变废除重要功能的H键,或导致空间位阻的冲突,从而破坏稳定的 TK 域结构。此外,半胱氨酸 Ser 突变的半胱氨酸参与 beta;alpha;minus;alpha;beta; 共价二聚化的IR损害其激酶功能。这些发现强调结构完整性的 IR 在下游细胞信号事件的重要性。糖尿病的合理药物设计的成功依赖于分子的结构的IR与无绑定胰岛素和最重要的是,IR基础跨膜信号转导的构象变化。
图1 胰岛素受体的图示。两个alpha;亚基是四个二硫键链接,即每个alpha;链是由 二硫键链接到beta;链。绑定的胰岛素分子的六角形,两个alpha;链交联所示。激活后,每个 beta; 链磷酸化酪氨酸 1158、1162和1163,被描绘成与字母 P 里面的小八角在其对应。
X 射线晶体学研究有种鉴定二硫键链接的胞外部分的IR具有 Lambda; 形的结构,主要由两个的 alpha; 亚基从反向平行的排列。结果表明胰岛素与 C-末端 alpha;-螺旋的 IR alpha;-亚基 (alpha;CT),导致胰岛素和激素结合 IR 胞外的区的构象直接变化。这些数据验证 insulinminus;IR 互动的“诱导网络(induced fit)”概念,并阐明配体结合的负协同效应和其他生化数据。
IR的TK 域暴露两个片段位于磷酸化位点的裂之间以防止ATP 结合以及IR 磷酸化环路的激活。三磷酸化可以造成很大的结构性转变,即在调整两个裂片和激活循环中,允许不受阻碍地的接近 ATP 和向目标胰岛素受体底物 (IRS) 蛋白激酶域的方向位移。对于形成二聚体的构象的一般区域作用中央磷酸激酶结构域需要进一步研究。
尽管这些宝贵的结构数据,相关领域的专家承认的胰岛素启动的信号转导机制在很大程度上仍然是难以捉摸,关键的机制问题仍然没有答案。这些问题如下所示。(i)防止自身磷酸化和无配体IR的活化的结构是什么?(ii) 什么结构的变化发生在胰岛素结合 IR 胞外区?(iii) 是怎样这些结构的变化在时间和空间传递到TK域?(iv)有哪些 TK 域产生的构象变化会引起受体自身磷酸化和激活?
圆二色性分光镜技术 (CD) 和荧光显微技术研究IR二级结构与胰岛素的结合,可能涉及更刚性螺旋的形成,并造成大量的第三和第四级结构性改变,导致两个原聚体的联系更密切。然而完整的IR功能的分子细节仍然不清楚。
因此,先研究短片段的 IR,即细胞的胞外区或胞内得到了原子分辨率结构。虽然这些研究阐明各个域的构象变化,但是它们之间的结构连接仍不清楚,导致跨膜信号转导的分子机制仍然无法解决。另一方面,光谱的应用不能提供IR发生在 alpha;-和 beta;-亚基之间相关结构变化的任何线索。使用适当时间分辨率的结构技术,通过IR光信号可以回答研究全长(alpha;beta;)2 IR分子关键的分子机制。
胰岛素信号转导
通过膳食摄入糖的哺乳动的胰岛beta;细胞分泌肽激素胰岛素,从而达到通过循环系统与所有器官的细胞质膜的IR光谱的配体结合域相结合。胰岛素具有限制触发一个或多个蛋白质磷酸化和激活,通过葡萄糖转运蛋白-4对细胞膜、 葡萄糖流动、 调节基因表达,肌细胞的蛋白质合成,甘油三酯合成的脂肪细胞,与肝脏糖原合成易位形成信号级联放大效应。这些进程在预防高血糖、 糖尿病、 脂肪过量沉积和由此引发的炎性反应等的代谢紊乱的调节中起到重要作用。
胰岛素介导的信号转导到细胞内,IR的激酶域是由多个酪氨酸残基组成的反式-自身磷酸化的受体(这两条并列的beta;链都能互相磷酸化)。紧接着在许多的过程中产生会在胞内产生局部蛋白磷酸化。磷脂酰肌醇3-激酶 (PI-3K) 通路中磷酸化的结构域1 将结合到的PI-3K亚基相关的结构域上,然后与膜脂质磷脂酰肌醇 4,5-二磷酸 (PIP2) 到 3,4,5-三磷酸肌醇 (PIP3)相互作用。PIP3的PH结构同源域含有酶,磷脂酰肌醇依赖性激酶 1 (PDK1)和Akt2。PIP3是由磷酸化和介导血浆膜易位的葡萄糖转运蛋白4结合Akt2和PDK1,其次是葡萄糖流动 (图2)。Akt2 的另一个功能是通过激活糖原合成酶激酶 3 (GSK3)触发糖原合成。
MAPK 通路中磷酸化的结构域1与Grb2蛋白质,然后将结合Sos,Src 同源2 域进行相互作用,后者激活 Ras 蛋白。连续的下游过程会激活 MAPK,经历核易位,调节不同的转录因子,从而调节基因表达,细胞增殖和细胞分化。
因此,胰岛素信号转导机制中央细胞代谢和生长,而IR跨细胞膜胰岛素信号转导中发挥了关键作用。分析的IR信号的结构基础至关重要的IR光谱和相应的受体,如胰岛素样生长因子-1 受体 (IGF1R) 和胰岛素受体相关受体 (IRR) 功能的分子机制的理解。
图2 激活的IR胰岛素和下游信号过程。IR激活后,紧接着是磷酸化蛋白质 IRS (步骤1和2)。在 PI-3 K 通路,磷酸化的结构域1将结合到PI-3K亚基上,然后与膜上的 PIP2 到 PIP3相结合。PIP3的PH 域包含激酶 PDK1 和 Akt2。PIP3 是由磷酸化和介导血浆膜易位的葡萄糖转运蛋白葡萄糖转运蛋白4与Akt2和PDK1相结合,其次是葡萄糖流动(步骤3minus;5)。Akt2也可以触发通过 GSK3 激活糖原合成 (步骤6和7)。在 MAPK 通路,与结构域1 进行相互作用的Grb2蛋白,紧接着连续的在下游蛋白-蛋白相互作用和磷酸化进程中激活 MAPK,经历核易位,调节不同的转录因子,从而调节基因表达,细胞增殖和细胞分化 (步骤8和9)。连接蛋白的八边形以字母 P 表示磷酸化。
用X 射线检测晶体结构
与单体、 单链受体酪氨酸激酶如表皮生长因子受体,IR受体家族,即,IR、 IGF1R 和 IRR,属于一个家族,成熟后成为2型四聚体(alpha;beta;)的蛋白质。性激素结合IR 的alpha; 亚基和酪氨酸激酶 beta;-亚基导致受体前体的裂解和由单个二硫键之间的alpha;-和 beta;-链共价键相连, (alpha; 链 Cys647 以及人类 IR 异构体 A,UniProt 条目 P06213 2,无视 N-端 27 残留信号序列的 beta; 链 Cys860)。(alpha;beta;)2四聚体成熟蛋白由两到四个二硫键alpha; 链 (图 1) 之间形成的。IR是一种糖蛋白带有19 N-聚糖和6 O-糖的alpha;亚基和不会干扰激素结合方式的胞外部分的beta;亚基。糖基化被认为有利于蛋白质折叠、 处理和膜易位。IR在 A 和 B 两种亚型之间的表达选择取决于外显子 11的选择性剪接 ,后者含有 alpha; 链羧基末端的 12 额外氨基酸残基。IR A 异构体与高亲和力结合胰岛素并执行主要胰岛素信号转导和有丝分裂功能的胰岛素样生长因子 (IGF)类似。在这篇文章的所有讨论是都指 A 异构体的IR。
巯基修饰连接的IR 胞外区(即,alpha; 亚基和 beta; 亚基的胞外部分)表明一个反平行排列的 Lambda; 形结构出现在从事广泛的分子间接触的两个原聚体之间(图 3) 。每个胞外区单体由两个富含亮氨酸重复域(L1和L2)之间介入富含半胱氨酸区域 (CR),和三个纤维蛋白原型三域 (FnIII 1,FnIII-2 和 FnIII-3)组成。应该指出的是,全长胞外区可能会改变结构,正如所记载的Menting et al和 Whitten et al 的抗原结合片段 (Fab) 分子形成了晶体。这个潜在的问题已经由IR微受体的晶体结构 (L1 CR alpha;CT697minus;719 域) 得到解决,这是处理的结晶稳定结构和alpha;CT段外区显示类似于在全长细胞域。然而,事实是在全长IR胞外区的结构中 C-末端结构中 alpha; 链区很不稳定,难以评估。这种结构和以前报告的数据中, 和提出的模型结合到IR上以及由此产生的构象变化的胰岛素,且胰岛素被建议要绑定到的 L1 和 CR 域的一个IR残存域,其次是交联的路口 FnIII-1 和 FnIII-2 域的其他残存域,导致高的affinity 二价绑定。交联从而导致分子间往来方便信号,最终导致反式-自身磷酸化IR beta;-链的两个IR亚基的组成。
人类的IR TK域包含激活循环 (残留域1149minus;1170) 携带重要磷酸化位点 (Tyr1158,Tyr1162 和 Tyr1163) 和非磷酸化形式的片段的结构显示组成扭曲、 五折叠的beta;折叠结构和alpha;螺旋(命名为 alpha;C)及 C-末端含有八个 alpha; 螺旋和四个 beta; 短链。激活循环是两个裂片,防止 ATP 的结合以及IR磷酸化的占领大部分的 ATP 结合区域之间。它提出了绑定到IR的胰岛素导致重排在第四级的受体——结构的一种,亚基磷酸化位点的定位其他激酶结构域,从而促进反式自磷酸化。
主要结构变化为同样的IR片段后激活了对于三磷酸激酶域 (TK3P),与 ATP 模拟和肽底物的 x 射线晶体结构。结构变化 TK3P 激活回路涉及大型 (最多 30 Aring;) 位移和调整两个裂片,允许不受阻碍地地访问 ATP 和 IR beta; 链的活性位点的靶蛋白。酪氨酸磷酸化,例如,破损的 Tyr1162minus;Asp1132 H 位点(伴随质子化催化 Asp1132) 和 P Tyr1163bull;bull;bull;Arg1155 和 P Tyr1162bull;bull;bull;Arg1164 H-位点,形成结构性后果已经鉴定。Beta;-钢绞线在 TK3P 配对重排离开 beta;10 钢绞线 (激活循环的一部分) 不成对,供与IRS蛋白质相互作用。
最近 x 射线晶体学研究较大 (328-残留) 片段的 IR beta;-链组成三磷酸激酶域,细胞质一般区域对于通过疏水性和离子接触而形成的 N 叶的激酶域的另一种分子一般区段结合于二聚体结构。通过下列机制,推断 TK3P 的二聚体构象对受体激活的作用。在基础状态下,一般区域与 alpha;C 螺旋 N 叶内同一残存的交互域和稳定激酶结构域的非生产性的形态是先前的提议。受体磷酸化成 N 叶的对应残存区段,构象,促进 ATP 的结合和底物磷酸化的 alpha;C 螺旋伴随高度结构转型与重新定位肩岬膜区域。因此,一般区段被认为具有抑制顺式和反式激活作用。中和非磷酸化和磷酸化状态的 TK 域的结构从而有IR酪氨酸激酶激活提供基础结构的重要线索。然而,正如由卡巴伊等人强调,它尚未确定明确如果长度短小的基底状态受体活性的是空间分离的激酶域或抑制二聚体形成的结果。此外,胰岛素绑定如何触发构象的变化,导致受体激活的主要问题仍然悬而未决。
图 3.人体IR胞外区在配体的状态 (PDB 及2DTG),所示的结构。一个残存区的紫色,和其他彩色的区域 ︰ L1-洋红色,铬黄;L2-绿色;FnIII-1,-2,-3 域——红色、 灰色和青色。两个配子反平行运行,与垂直的 2 倍旋转轴的对称性有关。一个胰岛素分子是一个残存的 L1 和 CR 域和其他 FnIII 1 域之间所示区域(PDB 及 1ZNJ)。注意到胞外区结构是载脂蛋白受体和胰岛素分子所示,仅仅表明激素结合位点而不是提出一个结构复杂的反应域。绑定的激素胞外区结构是可能的服务域(见图 4b 和 ref 44),但尚未确定。膜是会低于此结构,垂直于平面内的图片。
光谱研究
光谱和其他方法已经被用于评估基础结构的IR信号。Li等人观察到的流量增加色氨酸强度和各向异性的脂质重组胰岛素结合,大规模的构象变化的角度解释人类 IR。绑定到IR的三磷酸腺苷诱导色氨酸各向异性,以及迅速增加,这些大量存在 IR 绑定于胰岛素,间接暗示胰岛素诱导的 alpha; 亚基的构象变化达到 ATP 结合部位的IR beta; 亚基。提出了胰岛素绑定使色氨酸埋葬和之间两个 alpha; beta; 配基接近或更严格的接触。这个猜想,与丹胞相呼应,胰岛素绑定导致斯托克斯跌幅半径和增加 (alpha; beta;)2 沉淀 ,IR但不是 alpha; beta; 残存或IR胞外区的形式。
CD 的I
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[150932],资料为PDF文档或Word文档,PDF文档可免费转换为Word
以上是毕业论文外文翻译,课题毕业论文、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。
您可能感兴趣的文章
- 基于金属有机框架的固定化纤维素酶系统的开发以提高离子液体的耐受性和蔗渣原位糖化能力外文翻译资料
- 酶一金属混合催化剂的化学酶学反应外文翻译资料
- 维生素C对睡眠剥夺的减弱依赖于男性生育参数的恶化外文翻译资料
- 吐温80增强鞘磷脂菌GY2B对菲的生物降解的比较转录组学证据外文翻译资料
- 一项有关多环芳烃的重要综述——有关微生物降解的环境因素和办法外文翻译资料
- 黄荆叶提取物对多种耐多药肠道病原菌的体内外杀菌活性研究外文翻译资料
- 解开斑马鱼侧线胆碱能传出突触的分子参与者外文翻译资料
- 双酚A暴露诱导非洲爪蟾细胞凋亡,损害早期胚胎发育外文翻译资料
- 南非药用植物对产毒真菌的抗真菌、抗氧化活性和细胞毒性外文翻译资料
- 六堡茶发酵前后多糖的纯化、鉴定及生物活性研究外文翻译资料