用以分子内脱氧内酰胺为特征的基于罗丹明的传感器对醛类进行染色质检测
Chromo-fluorogenic detection of aldehydes with a rhodamine based sensor featuring an intramolecular deoxylactam
摘要:通过分析物触发N-(罗丹明B)-脱氧内酰胺-乙二胺(dRB-EDA)的脱氧内酰胺的开放实现醛的显色和荧光检测。 通过在细胞表面上展示显示醛的唾液蛋白的荧光标记来证实传感器的实用性。
关键词:N-(罗丹明B)-脱氧内酰胺-乙二胺(dRB-EDA) 显色 荧光检测 荧光标记
- 引言
醛是一组容易发生化学转化的活性化合物。 用于生产粘合剂,纺织品等的甲醛是环境中过敏和致癌的污染物。[1]甲醛暴露可能对人体健康造成有害影响,并且常常导致“病态建筑”综合症。 除了在工业中广泛使用外,醛类在生物医学研究中成为新兴的靶标,例如醛显示糖蛋白[2],含甲酰甘 氨酸的蛋白质[3],氧化DNA中甲酰基[4]的出现,癌症中甲醛的生成和释放甲醛的抗癌[5]药物在各种条件下(如活细胞中)灵敏检测醛类的方法非常适用于室内气态甲醛监测,细胞表面糖缀合物[6]成像和标记含醛蛋白[7]以定量生物系统中的醛。[4-6]
光学化学传感器在上述应用中是有利的,因为它们需要常规仪器并且提供用肉眼检测醛的可能性。 为了实现这一目标,已经开发了许多显色剂或致尿剂试剂来检测甲醛。[8] 现有的化学传感器中,腙通常用于捕获需要强迫条件形成有色 物质(如强碱催化)的醛8A-E,因此与活细胞中的应用不兼容。 另外,通过化学选择性连接将荧光报告基因引入细胞表面的糖蛋白[2]。我们希望开发敏感的传感器可以在温和条件下检测醛类而不添加任何催化剂。
罗丹明内酰胺是一组非荧光罗丹明衍生物,已被广泛研究用于荧光检测各种阳离子或化学反应性物质, 一氧化氮[9-10]。相反,罗丹明 - 脱氧内酰胺在分析物检测中大部分未被发现[11]。在此我们报道了通过分析物引发的罗丹明B衍生物的分子内脱氧内酰胺的开放的醛的荧光和显色检测。
方案1通过串联亚胺形成和分子内环化用dRB-EDA检测醛
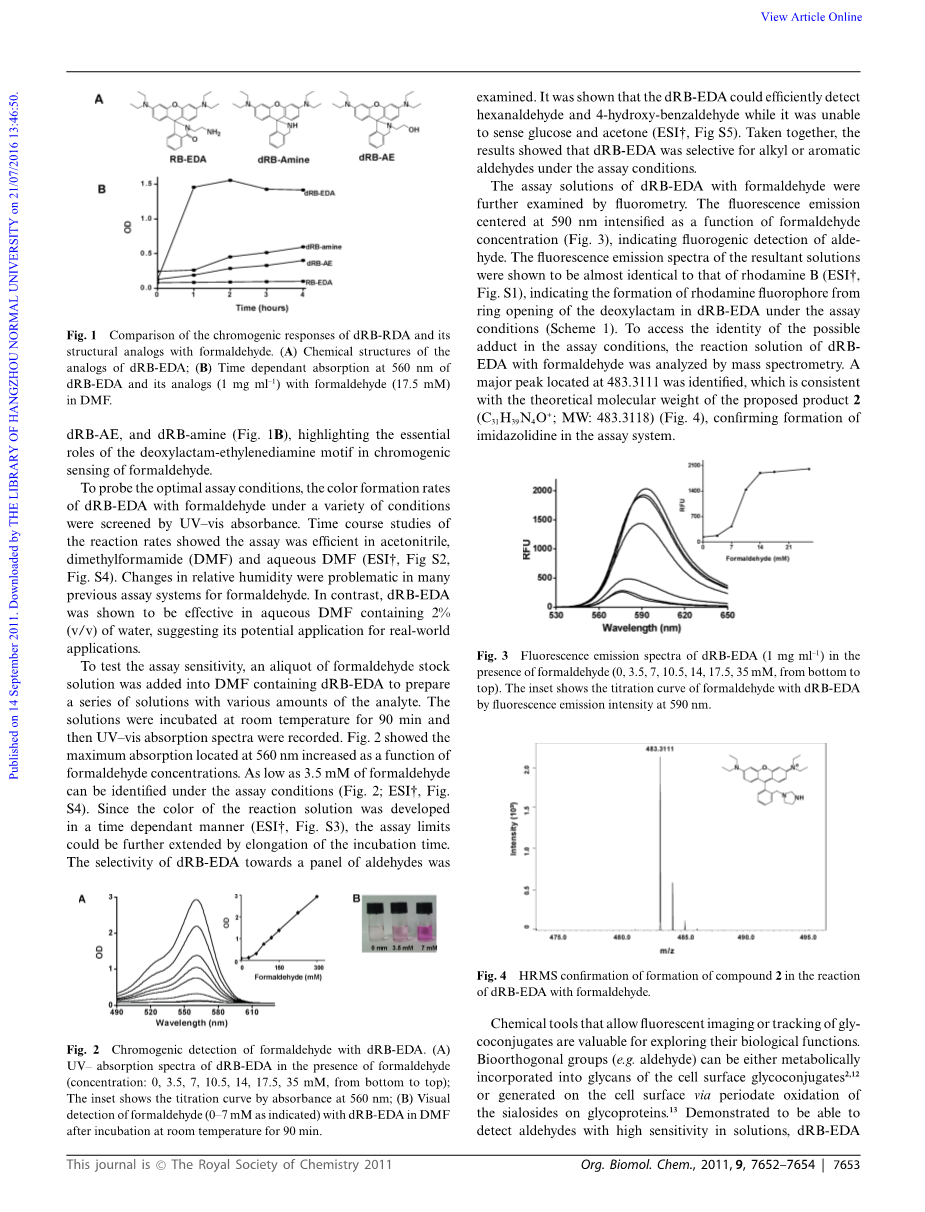
为了验证dRB-EDA的乙二胺部分在醛识别中所提出的作用,合 成了三种结构相关的dRB-EDA类似物并评价其在甲醛感应中的效果(图1A)。 在含有甲醛的DMF溶液中dRB-EDA,RB-EDA,N-(若丹明B)-脱氧内酰胺-2-氨基乙醇(dRB-AE)和N-(若丹明B)-脱氧内酰胺-胺(dRB-胺)分别通过在560nm处的UV-vis吸收作为时间的函数来监测。 结果表明,加入甲醛后,在dRB-EDA溶液中迅速形成红色,而RB-EDA没有观察到可辨别的吸光度(图1B)。RB-内酰胺的惰性可归因于阻碍分子内亚胺中间体3加成的酰胺部分的非亲核性质(ESIdagger;,方案S2)。相对于dRB-EDA,其传感动力学显着改善dRB-AE和dRB-胺(图1B),突出显示了脱氧内酰胺-乙二胺基序在甲醛显色检测中的重要作用。
图1 dRB-RDA及其结构类似物与甲醛的显色反应比较。 (A)dRB-EDA类似物的化学结构; (B)在DMF中dRB-EDA及其类似物(1mg / ml-1)与甲醛(17.5mM)在560nm处的时间依赖性吸收。
为了探索最佳测定条件,通过UV-vis吸光度筛选在各种条件下dRB-EDA与甲醛的颜色形成速率。反应速率的时间过程研究显示该测定在乙腈,二甲基甲酰胺(DMF)和DMF水溶液(ESIdagger;,图S2,图S4)中是有效的。许多以前的甲醛检测系统中相对湿度的变化是有问题的。相反,dRB-EDA显示在含有2%(v/v)水的DMF水溶液中有效,这表明其可用于真实世界的应用。
为了测试分析灵敏度,将等分的甲醛储备溶液加入到含有dRB-EDA的DMF中以制备具有不同量的分析物的一系列溶液。 将溶液在室温下孵育90分钟,然后记录UV-vis吸收光谱。图2显示560nm处的最大吸收随甲醛浓度的增加而增加。在测定条件下可以确定低至3.5mM的甲醛(图2;ESIdagger;,图S4)。由于反应溶液的颜色以时间依赖性方式产生(ESIdagger;,图S3),通过延长温育时间可以进一步延长测定限度。dRB-EDA对一组醛的选择性是检查。果表明,dRB-EDA能够高效检测己醛和4-羟基苯甲醛,但不能检测葡萄糖和丙酮(ESIdagger;,图S5)。总之,结果显示dRB-EDA在测定条件下对烷基或芳香醛是选择性的。
图2用dRB-EDA显色检测甲醛。 (A)在甲醛存在下dRB-EDA的紫外吸收光谱(浓度:0,3.5,7,10.5,14,17.5,35mM,从下到上); 插图显示560 nm吸光度的滴定曲线;(B)在室温孵育90分钟后,用DMF中的dRB-EDA对甲醛(如所示0-7mM)进行视觉检测。
dRB-EDA与甲醛的测定溶液进一步用量热法进行检测。以590nm为中心的荧光发射随甲醛浓度的变化而增强(图3),表明醛的检测不到。显示所得溶液的荧光发射光谱与罗丹明B(ESIdagger;,图S1)的荧光发射光谱几乎相同,表明在测定条件下dRB-EDA中脱氧内酰胺的开环形成罗丹明uorophore(Scheme 1)。为了在测定条件下获得可能的加合物的身份,通过质谱分析dRB-EDA与甲醛的反应溶液。确定了位于483.3111的主峰,这与所提出的产物2(C31H39N4O ; MW:483.3118)的理论分子量(图4)一致,从而确定了测定系 统中咪唑烷的形成。
图3在甲醛存在下( 0,3.5,7,10.5,14,17.5,35mM, 从下到上), dRB-EDA(1mg/ ml-1)的荧光发射光谱。 插图显示590nm下荧光发射强度与dRB-EDA的甲醛滴定曲线。
图4在dRB-EDA与甲醛的反应中形成化合物2的HRMS确认
允许荧光成像或跟踪糖缀合物的化学工具对于探索其生物 功能是有价值的。生物正交基团(例如醛)可以代谢地结合到细胞表面糖缀合物[2,12]的聚糖中或通过糖蛋白上的唾液酸 糖苷的高碘酸盐氧化在细胞表面上产生[13]。证明能够以高灵敏度检测醛解决方案,dRB-EDA评估了它在标记细胞表面醛类方面的效果。在细胞表面[14]上大量表达唾液蛋白的L929细胞进行高碘酸盐氧化,从而在建立的程序后在唾液酸糖苷的C-7位引入醛部分(图5A)[13]将所得细胞进一步处理与dRB-EDA,然后用共聚焦荧光显微镜进行分析。图像显示标记完全在用高碘酸盐氧化的细胞表面上,而在对照细胞上未观察到标记(图5B)。细胞表面限制性染色与唾液酸化蛋白质大量定位于质膜中这一事实相符。用或不用高碘酸盐处理的细胞的不同标记模式表明用dRB-EDA进行的细胞表面聚糖的荧光标记是醛特异性的。
图5细胞表面唾液蛋白的荧光标记。 (A)标记通过细胞表面唾液酸糖苷的高碘酸盐氧化随后通过用dRB-EDA化学选择性连接生成的醛来实现;(B)用或不用高碘酸钠预处理的dRB-EDA标记的L929 细胞的共焦显微镜图像。
鉴于罗丹明的卓越的荧光特性,例如高荧光量子产率,生物正交荧光光谱和高光稳定性,用dRB-EDA对细胞表面醛进行化学选择性和无营养标记表明含有脱氧内酰胺的罗丹明在观察或追踪活细胞表面唾液蛋白中的潜在用途细胞。
总之,通过分析物介导的分子内脱氧内酰胺的开放,在温和条件下设计了dRB-EDA(一种含有罗丹明-脱氧内酰胺的乙二胺),用于无氧和显色的醛检测。该传感器能够以严格的选择性标记细胞表面醛显示唾液蛋白。鉴于若丹明的卓越的荧光特性,dRB-EDA 不仅可用于借助仪器或可能用“裸眼”检测甲醛,而且还可用于许多生物应用,例如评估释放甲醛的抗癌药物,并在一些癌症中定量内源性甲醛。
致谢
S. Han博士获得NSF China(20802060,21072162),中国福建省自然科学基金(2011J06004)和中央大学基础研究基金(2011121020)的资助。 J. Han博士获得NSF中国(30830092,30921005,91029304, 81061160512)和973程序(2009CB522200)。
参考文献
[1] R.L.Maynard, Occup. Environ. Med., 2000, 57, 502D.
[2] Y. Zeng, T. N. Ramya, A. Dirksen, P. E. Dawson and J. C. Paulson,Nat. Methods, 2009, 6, 207.
[3] B. Schmidt, T. Selmer, A. Ingendoh and K. von Figura, Cell, 1995, 82,271.
[4] W Hirose, K. Sato and A. Matsuda, Angew. Chem., Int. Ed., 2010, 49,8392.
[5] (a) J. R. Ghilardi, H. Rohrich, T. H. Lindsay, M. A. Sevcik, M. J.Schwei, K. Kubota, K. G. Halvorson, J. Poblete, S. R. Chaplan, A. E.Dubin, N. I. Carruthers, D. Swanson, M. Kuskowski, C. M. Flores,D. Julius and P. W. Mantyh, J. Neurosci., 2005, 25, 3126; (b) M. A.Sabino and P. W. Mantyh, J. Support. Oncol., 2005, 3, 15; (c) S. E.
Ebeler, A. J. Clifford and T. Shibamoto, J. Chromatogr. B Biomed. Sci.Appl., 1997, 702, 211; (d) P. Spanel, D. Smith, T. A. Holland, W. AlSingary and J. B. Elder, Rapid Commun. Mass Spectrom., 1999, 13,1354.
[6] (a)L.Bareket, A.Rephaeli, G.Berkovitch, A.Nudelman and J .Rishpon, Bioelectrochemistry,2010,77,94;(b)M.Ugarenko,C.K.Chan,A. Nudelman, A. Rephaeli, S.M.Cutts and D.R.Phillips,Oncol. Res., 2009,17,283;(c)S.M.Cutts,A.Nudelman,V. Pillay,D.M.Spencer,I.Levovich,A.Rephaeli and D.R.Phillips,Oncol.Res.,2005,15,199; (d)I.Levovich,A.Nudelman,G.Berkovitch,L.P.Swift,S.M.Cutts,D.R.Phillips and A. Rephaeli,Cancer Chemother.Pharmacol.,2008,62,471.
[7] I.S.Carrico,B.L.Carlson and C.R.Bertozzi,Nat.Chem.Biol.,2007,3,321.
[8] (a)M.I.Helaleh,M.Kumemura,S.Fujii and T.Korenaga,Analyst,2001,126,104;(b)K. Kawamura,K.Kerman,M.Fujihara,N.Nagatani,T.Hashiba and E.Tamiya,Sens. Actuators,B,2005,105,495;(c)G.J.Mohr,U.E.Spichiger,W.Jona and H.Langhals, Anal.Chem.,2000,72,1084;(d)M.S.Quesenberry and Y.C.L
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 3 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[281113],资料为PDF文档或Word文档,PDF文档可免费转换为Word
以上是毕业论文外文翻译,课题毕业论文、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。
您可能感兴趣的文章
- 合成与光催化从新型二氧化铈和掺银二氧铈中光解水制氢静电纺丝法制备纤维外文翻译资料
- 利用2-苯基-1h-咪唑基丹参酮IIA衍生物选择性稳定多个启动子g-四重体DNA及其在转移性乳腺癌中的潜在抑制作用外文翻译资料
- 直接芳基化反应和非均相催化的结合外文翻译资料
- “顺势疗法”钯纳米颗粒催化交叉碳–碳偶联反应外文翻译资料
- 磁性纳米粒子负载离子改性TBD:一种应用于有机转换的高效、可回收催化剂外文翻译资料
- 扩展的紫罗碱综合环芬CdS量子点中的超快的两电子转移外文翻译资料
- 实现一个重要明显增加EFfi效率在相应的纯蓝色荧光OLED:准等价的杂化态外文翻译资料
- 基于咪唑-π-三苯胺衍生物的高效深蓝色有机发光装置外文翻译资料
- 从3-氨基-1-丙醇或3-卤丙胺氢卤化物出发,通过n -三硝基或n -二甲氧基三苄基lazetiine高效合成氮叠丁外文翻译资料
- 气相色谱引样方法外文翻译资料


